
又一例资本市场犒赏核心技术的案例发生在了大洋彼岸。
北京时间12月14日-15日两个交易日内,一家名不见经传的美国医药上市公司,股价累计暴涨122%。
这家公司名叫Arvinas(NASDAQ:ARVN)。点燃其股价一夜翻倍的火捻子,是一项更为中国投资者陌生的小分子靶向药物技术:PROTAC。
什么是PROTAC技术?它有着怎样的发展历程?Arvinas是何方神圣?其中又蕴含怎样的投资机遇?
01
下一代抗肿瘤明星
在讲解深奥的学术性语言之前,我们先通过一些案例来了解PROTAC的作用机制。就以中国女性发病率最高的癌症——乳腺癌为例。
乳腺癌,是发生在乳腺腺上皮组织的恶性肿瘤,99%发生在女性。根据临床流行病学调查结果表明,乳腺癌的发生,与雌激素、遗传、放射性等密切相关。
同时,乳腺癌也被戏称为“女人甜蜜的烦扰”。因为大量研究数据表明,大胸的女孩更容易患乳腺癌。原因在于,大胸的女孩不愿意运动。根据英国科研团队调查,46%少女表示自己的胸部是运动的拦路虎,尤其大胸女孩(63%)不愿意参与锻炼。其中,超过50%的人从未戴过运动胸罩。
另一方面,根据英国动物学杂志资料显示,“可能的原因是拥有大胸的女性雌激素水平更高,而正常乳腺细胞的癌变恰恰就是在雌激素不断刺激下一步一步慢慢发展的。并且过高的雌激素还可能抑制免疫系统,从而使免疫系统无法识别癌变细胞。”
作为肿瘤疾病,乳腺癌的治疗也有手术、放疗、化疗、靶向治疗等手段。其中,随着精准医疗技术的发展,靶向治疗占了举足轻重的地位。
在众多治疗乳腺癌的靶向药中,罗氏制药的曲妥珠单抗(商品名:赫赛汀)和辉瑞的哌柏西利(商品名:爱博新)都是全球知名药物,被称为“乳腺癌杀手”。
所谓靶向治疗,是一种针对已经明确的致癌位点的治疗方式。简单来说,就是有什么样的靶点,就有什么样的靶点药物。
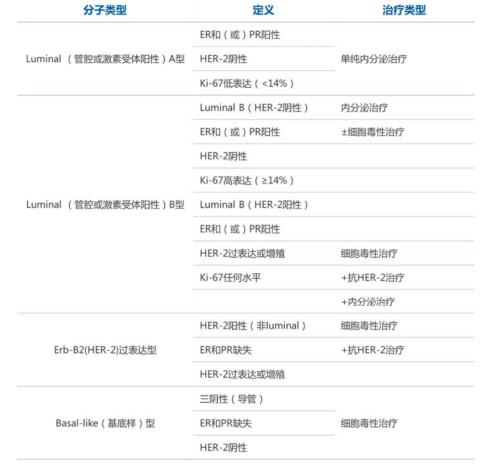
图1:乳腺癌分子亚型的定义和治疗推荐(2011年 St.Gallen共识)来源:头豹研究院
比如,乳腺癌患者中存在大量的HER2阳性基因突变,那么对应的就存在以HER2为靶点的治疗药物。而曲妥珠单抗就是一种抑制HER2阳性肿瘤细胞生长的HER2单克隆抗体,可用于治疗HER2阳性的乳腺癌患者。
除了HER2受体阴性以外,激素受体(HR)阳性也是乳腺癌最常见的类型。比如,哌柏西利就是一种CDK4/6抑制剂,是用于治疗晚期HR+/HER2-乳腺癌的一线药物。
目前,国内在研ADC药物(antibody-drug conjugate,抗体药物偶联物)中多以HER-2靶点为主。从研发进度看,截至2020年8月底,东曜药业(HK:01875)的抗HER-2 ADC药物已处于临床Ⅲ期,并完成首例患者给药,具备先发优势。其次,百奥泰(688177,诊股)(SH:688177)也处于Ⅲ期阶段。
另外,还有荣昌生物(HK:09995)、上海医药(601607,诊股)/复旦张江(688505,诊股)、海正药业(600267,诊股)(SH:600267)、恒瑞医药(600276,诊股)(SH:600276)等也已进入临床阶段。
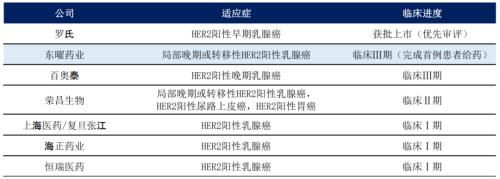
图2:抗HER-2ADC药物国内竞争格局来源:公司招股书,第一上海
从作用机制看,前面提到的曲妥珠单抗和哌柏西利,分别是通过抑制HER2蛋白或者抑制CDK4、CDK6蛋白,也就是抑制肿瘤生长达到治疗的效果,属于抑制蛋白范畴。
本文的“主角”PROTAC技术,则是属于降解蛋白范畴。
有统计显示,大约75%的乳腺癌是雌激素受体(ER)阳性,目前也有对应药物,例如新型的雌激素受体拮抗剂——氟维司群(商品名:芙仕得),能够显著延长雌激素受体阳性的晚期乳腺癌患者的无恶化生存期。
但不同的是,Arvinas公司正在进行一项治疗乳腺癌雌激素受体(ER)降解的临床试验,所运用的技术正是PROTAC。
Arvinas公司,由PROTAC技术的主要发明人耶鲁大学Craig Crews教授成立于2013年。公司一直专注蛋白降解PROTAC技术,目前有ARV-110和ARV-471两个重点研发项目。
其中,ARV-471作为靶向雌激素受体(ER)的蛋白质降解剂,能够治疗局部晚期或转移性ER阳性/ HER2阴性乳腺癌。而ARV-110则用于治疗前列腺癌的雄激素受体(AR)的降解。
据公司介绍,PROTAC蛋白降解剂利用人体的天然蛋白回收系统来降解导致疾病的蛋白,能够募集E3连接酶来为靶标蛋白装上泛素的标签,这会引导这些蛋白被蛋白酶体降解。在靶标蛋白被降解之后,PROTAC蛋白降解剂会被释放并且可以重新被用于降解其它靶标蛋白。
说到这里,我们可以引出定义:
PROTAC(PROteolysis TArgeting Chimera)是一种双功能小分子化合物,该小分子化合物类似一个跷跷板,一端是结合靶蛋白的配体,另一端是结合E3泛素连接酶的配体,配体之间通过一个linker连接,形成一个复合物,拉近靶蛋白与E3连接酶从而促进靶蛋白的泛素化,使其进入泛素-蛋白酶体降解途径,达到降解靶蛋白的目的。
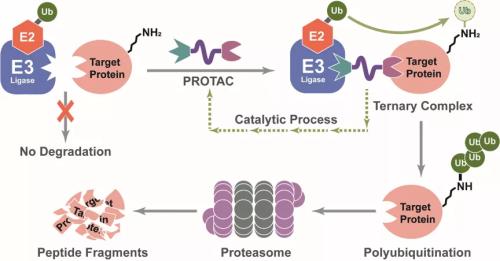
图3:PROTAC的作用机制
通俗地说,PROTAC技术就是利用细胞“清洁工”(泛素-蛋白酶体系统)来清理细胞中无用或者有害的蛋白,通过激活这个清洁器从而特异性的扫除致癌蛋白。
因此,只需药物短暂地与致癌蛋白结合,并且蛋白被降解后需要重新合成才能恢复功能,这样能保持机体长久的稳定,延缓耐药性的产生,非常适合与癌症做持久战斗。
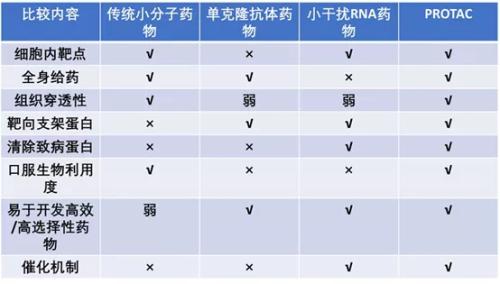
图4:PROTAC与其它技术的区别
对比来看,传统的靶向药需要与目标蛋白(通常是其活性位点)牢固结合,由于PROTAC蛋白质降解剂仅需与目标蛋白弱结合便能对其进行特异性“标记”,因此PROTAC降解剂可能解决目前“不可成药”的约80%蛋白质组。
如是,作为蛋白降解疗法的PROTAC技术,凭借“破解不可成药的靶点”优势,对不能进行传统靶向治疗的患者雪中送炭,并因此将成为新一代肿瘤治疗的明星产品。
02
重新定义小分子药?
众所周知,药物分为化学小分子药物(化学药)和生物大分子药物(生物制剂)两种。PROTAC技术显然属于前者,而单抗、多肽和蛋白、核酸等属于后者。
说起小分子药物,它曾经有过一段沉寂之路。
在抗体药物等生物药还没崛起之前,小分子药物凭借由化学合成或从自然物质提纯而来,相对更简单的优势,成为曾经支撑制药工业的主打产品。
但是,由于小分子药物的化学式、结构式非常明确,因此相对结构复杂、生产工艺要求苛刻的生物药,更容易受到非专利药物的影响,导致长期销量不佳。因此,制药公司纷纷转向研发生物药,使得曾经占据霸主地位的小分子药陷入长达10多年的沉寂。
尤其是,随着近10年来以单抗为代表的生物药高速增长,小分子药再次受到冲击。根据IQVIA数据显示,从头部重磅品种看,2019全球销售额TOP100的药品中,小分子销售额总体增速为5%,生物药则达到11%,并且TOP100品种中生物药的数量首次追平小分子药物。
所以,医药圈就有了“全球药物市场已完全进入生物药时代”的判断。
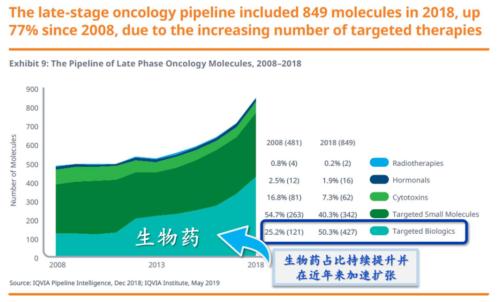
图5:全球肿瘤药研发趋势,生物药比例反超小分子来源:IQVIA,国盛证券研究所
不过,随着PROTAC技术的崛起,小分子药被重新定义,再次回到聚光灯下。
PROTAC的发展历程:
2001年,加州理工大学的Raymond J. Deshaies教授和耶鲁大学的Craig M. Crews教授首次提出PROTAC的概念。起初,由于PROTAC分子的设计只限于多肽水平,难以在细胞内实现靶蛋白的有效降解,因此Crews等人的研究一直没有突破性的进展。
直到2015年,James E. Bradner、Crews等课题组首次报道了可以在体内有效降解靶蛋白的PROTAC分子的相关研究,使得PROTAC技术受到了药物研发人员的极大关注。
后来,BRD4、RIPK2、ERRα、BRD9、TBK1、Sirt2、CDK9、p38α、Pirin、c-Met、EGFR、FAK、FLT3等蛋白先后被报道可以利用PROTAC技术将其降解。随着能被降解的靶点越来越多,PROTAC技术被运用于各种疾病的临床研究就越来越广泛。
除了作用靶点广以外,PROTAC的价值远不止于此。它还有着诸多优势。
1、成药性高
PROTAC技术,之所以被称为“破解不可成药靶点神器”,正因为它能攻克传统药物难以成药的靶点。
PROTAC能将靶点从“无成药性”变成“有成药性”。人体细胞中约有80%的蛋白缺乏酶活性或者表面缺乏成药位点的蛋白,而PROTAC可以捕捉到这些难以成药的蛋白,并进行降解。
比如,2020年4月10日,至今30多年无靶向KRAS的药物获批上市的、被药界称为“不可成药”的靶点KRAS,被CREW(Arvinas公司创始人)团队攻克了:开发了降解KRASG12C突变体的PROTAC分子LC-2,能快速降解不同纯合体和杂合体肿瘤细胞中的KRASG12C,是报道的首个可以降解内源性KRASG12C的化合物。
这么一看,PROTAC不是“神器”,简直就是医药界Bug一般的存在。
2、耐药性
由于点突变的存在,一些激酶的小分子抑制剂经常产生耐药性,失去对靶蛋白的抑制作用,而PROTAC技术可以直接将靶蛋白降解,可以避免这一问题。
例如,2019年3月,清华大学药学院饶燏教授及团队在体内试验中证明,利用PROTAC技术降解多种突变型BTK蛋白,能够有效抑制治疗慢性淋巴细胞白血病等B细胞癌的全球知名BTK抑制剂依鲁替尼耐药性。
3、多种给药途径
传统的小分子药物主要以口服为主,但PROTAC技术可以满足不同患者的需求,可口服给药、也可注射,避免了因长期静脉注射带来的心血管负担。
4、用量小,毒性和药物抗性低
这个过程类似于催化反应,药物又可以重复利用,抑制目标蛋白,并不需要等摩尔量的药物,使用催化剂量即可达到效果,无须足够大的剂量使靶点饱和,所以对PROTAC的活性要求也许不需很高,可选择性高,而且无须足够长的半衰期即可持续抑制。
此外,PROTAC小分子还有清除蛋白堆积,以及可以在蛋白表达、修饰后选择性降解同一基因表达的不同蛋白等优势。
03
全球掘金者
目前,全球已有不少制药公司布局PROTAC技术研发。
例如,具备先发优势的Arvinas、C4 Therapeutics、Kymera Therapeutics等,后来跟进布局的公司有默克、基因泰克、辉瑞、诺华、勃林格殷格翰等跨国制药巨头。国内如恒瑞医药、凌科药业、分迪科技、苏州开拓药业等都有涉猎。
其中,研发成果最突出的,当属PROTAC技术主要发明人Crews教授创立的Arvinas公司。
12月14日,Arvinas发布了ARV-110针对前列腺癌患者的临床数据。同时,还公布了其产品管线中另一款药物ARV-471针对乳腺癌患者中的I期积极疗效数据。利好消息一出,Arvinas以暴涨95%收盘,市值达到23.67亿美元。
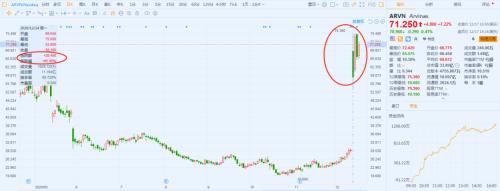
图6:Arvinas公司2020年5月以来股价走势图 来源:富途牛牛
Arvinas首席执行官John Houston博士表示:“在乳腺癌和前列腺癌这两类患者人群中都看到了肿瘤缩小和低不良反应发生率的获益。”
据资料显示,ARV-471可以ER水平最高下调90%,平均下调62%,优于标准疗法氟维司群的40%-50%。安全性方面,ARV-471所有剂量水平在数据截止日时耐受性良好。
ARV-471在I期研究中的安全性和耐受性方面具有best in class的潜力。
Arvinas计划在ER+/HER2-全面评估ARV-471的治疗潜力,ARV-471联合Ibrance(哌柏西利)作为一线疗法的Ib期研究预计将于2020年12月开始,ARV-471的II期扩展队列预计于2021上半年开始。
另外,公司的另一款在研新药ARV-110已启动一项II期剂量扩展研究,探索ARV-110的两种开发策略。
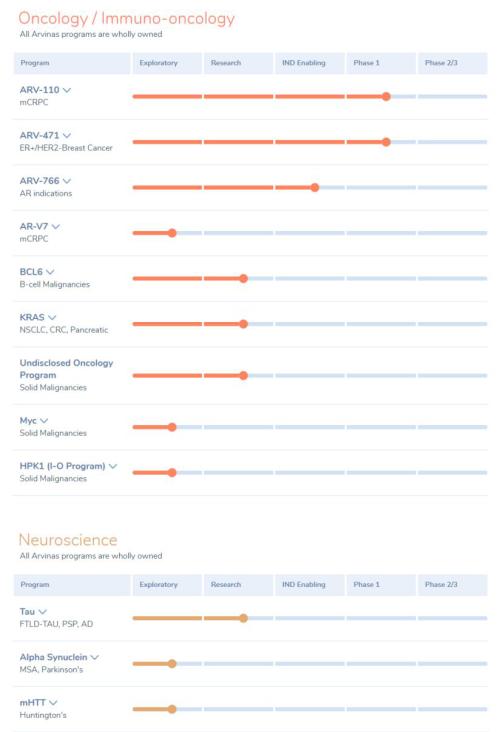
图7:Arvinas研发管线 来源:公司官网
同时,Arvinas也关注神经科学领域。其中在研的两个靶点分别是tau蛋白和α-突触核蛋白。其中靶向tau蛋白是为了治疗阿尔茨海默病,而靶向α-突触核蛋白是为了攻克帕金森症。他们已经证实那些比传统小分子药物稍大一点的PROTAC药物能够穿透血脑屏障。
据动脉网显示,PROTAC初创企业同时吸引了多家资本注入,其中国外的Nextech Invest和Third Rock Ventures投资了Arvinas等多家PROTAC初创公司,国内的红杉资本、民和资本、弘晖资本、通和毓承也有参投。
国内布局PROTAC的公司研发虽尚处于早期阶段,但也吸引到了凯泰资本、弘晖资本等的投资。
比如,2019年7月,恒瑞和上海宏创医疗科技有限公司收购了Princeps Therapeutics 31%的股权,恒瑞出资120万美元,上海宏创医疗科技有限公司出资280万美元,Princeps Therapeutics是一家生物技术公司,开发E3连接酶抑制剂。
另外,分迪科技建立了PRODEDTM小分子靶向蛋白降解新药研发平台;苏州开拓药业的蛋白PROTAC在筛选化合物确认阶段等。
总结来看,PROTAC技术凭借其独特的优势,已经成为目前药物研发的新策略。
不过,虽然PROTAC技术正戴着“明星光环”,但能否带领传统小分子药再次崛起,取决于未来几年能否获得更大的临床疗效。
更重要的是,国内制药企业能否借此发展良机,向“best in class”发起冲击,最终与国际制药巨头同台竞争,我们拭目以待。